|
UNIDAD DIDÁCTICA 5
|
|
|
ÁTOMOS, MOLÉCULAS Y CRISTALES |
 |
Durante la mayor parte de la historia de la humanidad, ésta conoció y empleó una serie bastante limitada de sustancias puras, que obtenía directamente o purificaba a partir de otras sustancias presentes en la naturaleza. Así, hasta la Edad Media, las sustancias puras conocidas eran: o. En la Edad Media y Renacimiento, los alquimistas fueron capaces de aislar otras sustancias como:.
En 1.661 Robert Boyle propuso una definición de elemento:
"Los elementos son ciertos cuerpos primitivos y simples que no están formados de otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen y en los que se resuelven en último término todos los cuerpos compuestos."
Este concepto, aceptado por Antoine L. Lavoisier, llevó a los científicos a investigar qué sustancias de las entonces conocidas eran elementos, lo que provocó el descubrimiento de nuevos elementos: .
Durante el siglo XIX se continuaron descubriendo nuevos elementos y también se mejoró en el conocimiento acerca de las propiedades físicas y químicas de todos ellos. De esta acumulación de saber surgió la necesidad de encontrar alguna forma de clasificarlos u ordenarlos sistemáticamente, tomando como base dichas propiedades.
A primera vista, esta tarea parecía muy difícil, pues parecía que cada elemento tenía un conjunto de propiedades único que lo diferenciaba de los demás elementos:
Sin embargo, esa misma acumulación de datos, llevó a una línea de pensamiento que trataba de relacionar los pesos atómicos de los elementos con sus propiedades químicas. Desde hacía tiempo se conocía la existencia de "familias" de elementos que tenían un comportamiento químico similar. Es el caso de la familia de los halógenos:
Algo parecido ocurría con otro grupo de elementos, los metales alcalinos, que incluye al litio (Li), sodio (Na), potasio (K), rubidio (Rb) y cesio (Cs).
En la búsqueda de relaciones entre los elementos, hubo científicos que propusieron ciertas regularidades como, por ejemplo:
Sin embargo, estas regularidades tenían una validez escasa pues tenían muchas excepciones. No fue hasta las investigaciones de Dimitri Ivanovitch Mendeleiev cuando se consiguió una clasificación coherente, correcta y total que, básicamente es la que se emplea en la actualidad.
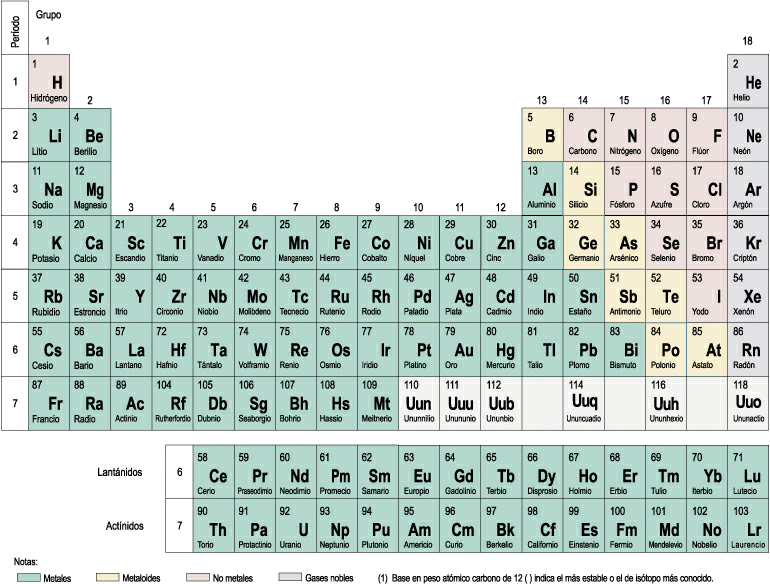
En la actualidad, los elementos se ordenan según el valor de sus números atómicos, dependiendo su posición en la tabla, por tanto, de su número de protones en el núcleo y, en consecuencia, de su número de electrones.
La tabla resultante, llamada tabla periódica porque muchas características de los átomos se van repitiendo al avanzar por ella, presenta las siguientes propiedades:
Sin embargo, también tiene algunos inconvenientes:
El elemento hidrógeno tiene unas propiedades que no se ajustan a las de ningún grupo, por lo que se le suele colocar tanto en el primer grupo (tiene sólo un electrón en su capa electrónica) como en el grupo 17 (le falta un electrón para completar su capa electrónica). En algunas tablas se le sitúa aparte.
Los elementos de números atómicos 58 a 71 y 90 a 103 se les sitúa fuera de la tabla, pues ésta se haría, en caso contrario, muy larga e inmanejable.
2.1- Los símbolos de los elementos
A cada elemento se le ha asignado un símbolo formado por una o dos letras: si tiene una sola letra, ésta se escribe en mayúscula; si tiene dos, la primera letra se escribe en mayúscula y la segunda en minúscula.
Pulsa sobre el
dibujo de la tabla para conocer el origen de estos símbolos y qué representan:
![]()
En el siguiente enlace tienes un juego para aprender los símbolos de los elementos: ENLACE
2.2- Regularidades de las propiedades de los elementos de la tabla periódica
| Propiedad | ¿Cómo varía? |
| ●Carácter metálico |
Dentro de un mismo periodo: aumenta de derecha a izquierda. Dentro de un mismo grupo: aumenta a medida que se desciende.
|
| ●Número de electrones externos. |
Aumenta en una unidad al pasar de un elemento al siguiente en un periodo. Dentro de un mismo grupo, es el mismo
|
| ●Puntos de fusión y ebullición |
En un periodo, al principio aumenta
hasta la mitad del mismo, para después disminuir.
|
| ●Formación de óxidos (excepto el argón, que no reacciona con el oxígeno) |
La proporción entre el número de
átomos de oxígeno y el número de átomos del elemento que entran en reacción
aumenta a lo largo del periodo.
|
| ●Propiedades físicas y químicas |
Son parecidas en los elementos de un
mismo grupo.
|
Por último, si pulsas sobre el
dibujo de la tabla adjunto, te aparecerá una tabla periódica interactiva, con
información de los elementos y los grupos:
![]()
3.- LA AGRUPACIÓN DE LOS ÁTOMOS EN LA MATERIA
Como ya sabes, en la naturaleza podemos encontrar:
Para poder formar tanto un tipo de sustancia como la otra, los átomos se han de organizar para conseguirlo. De esta forma, pueden aparecer de las siguientes formas:
3.1- Átomos aislados
Este caso sólo se da en los elementos del grupo 18 de la tabla periódica. Al tener completa su última capa electrónica tiene un carácter tan estable que no se suelen combinar ni consigo mismo ni con otros elementos (origen del nombre de gases nobles o inertes).
Todos los demás elementos, al no tener completa su última capa electrónica, tratan de conseguirlo mediante su asociación con otros átomos, formando moléculas o cristales. Para alcanzar la estabilidad electrónica, los átomos de los elementos se unen mediante un enlace químico, que es una fuerza de atracción de naturaleza electrostática.
3.2- Moléculas
Para formar moléculas, los átomos que intervienen comparten electrones entre sí. En este caso se habla de enlace covalente. En la siguiente página tienes más información y un ejercicio de aplicación: ENLACE
Los átomos que intervienen en la formación de las moléculas pueden ser:
Las moléculas, en general, se mantienen prácticamente aisladas o unidas por fuerzas débiles entre sí y tienen las siguientes características:
Las moléculas se representan mediante fórmulas moleculares, que indican el número y la clase de átomos que intervienen. Por ejemplo: H2O, significa que en esta molécula hay dos átomos de hidrógeno y uno de oxígeno.
3.2- Cristales
Los cristales son sólidos cuyas partículas constituyentes (átomos, moléculas o iones) se ordenan conforme a un patrón que se repite en las tres direcciones del espacio. Se distinguen tres tipos de cristales según el tipo de enlace químico que se establece entre las partículas.
Los cristales se representan mediante fórmulas empíricas, que indican la proporción de los diferentes átomos que forman el compuesto. Por ejemplo: NaCl, significa que hay un átomo de cloro por cada átomo de sodio.
Cristales covalentes
La unión entre los átomos es mediante enlace covalente. Esto origina sólidos muy duros, de puntos de fusión y ebullición muy elevados y que no conducen la corriente eléctrica.
Ejemplos de cristales covalentes: diamante, grafito, cuarzo
Cristales metálicos
Los átomos constituyentes están unidos por enlace metálico:
Los elementos metálicos poseen 1, 2 ó 3 electrones en la capa electrónica externa de sus átomos, los cuales están débilmente unidos al núcleo por lo que se pueden perder con facilidad. Cuando un conjunto de átomos de estos elementos se acercan hasta estar lo más cerca posible, las capas electrónicas externas se solapan por completo, haciendo que los electrones ya no estén asociados a un átomo en concreto, sino que son compartidos por todos los átomos del conjunto. Esto se puede ver en la siguiente página web: ENLACE.
Los cristales metálicos tienen las siguientes propiedades:
Cristales iónicos
Los átomos de ciertos elementos consiguen completar su última capa electrónica mediante la pérdida o ganancia de electrones:
Cuando los átomos de un metal y un no metal se encuentran, el primero cede electrones al segundo. Como resultado, el metal se convierte en catión y el no metal se convierte en anión, es decir, dos iones con cargas eléctricas opuestas que, en consecuencia, se atraen entre sí mediante fuerzas de atracción electrostática. Este tipo de enlace químico se conoce como enlace iónico. ENLACE
Esta atracción no se limita a un solo ion, sino que cada uno se rodea del máximo número de iones de carga opuesta que pueden rodear a un ion en particular posible. El resultado es un cristal iónico.
Los cristales iónicos tienen las siguientes propiedades:
4.- MASA MOLECULAR RELATIVA. COMPOSICIÓN CENTESIMAL
La masa molecular relativa de una sustancia es igual a la suma de las masas atómicas relativas de los átomos que aparecen en su fórmula.
Para practicar, aquí
tienes una calculadora de masas moleculares.![]()
4.1- Composición centesimal
Una propiedad de todo compuesto químico es la proporción fija que existe entre los átomos de los elementos que lo componen. Por eso, una vez conocida la fórmula de un compuesto quimico, es fácil calcular su composición centesimal, que es el tanto por ciento de la masa total correspondiente a cada uno de los elementos. Se calcula de la siguiente manera:
| % de un elemento = | masa total del elemento | x 100 |
| masa total del compuesto |
Aquí tienes dos páginas (en inglés) para calcular la masa molecular y la composición centesimal de un compuesto a partir de su fórmula.
ENLACE1:escribe la fórmula (símbolos y números en orden correcto) en la casilla "Molecular Formula". Pulsa el botón "Calculate" (Calcular) y los resultados aparecen junto a las casillas "Molecular weight" (masa molecular) y "Element %" (composición centesimal). Para calcular otro compuesto, debes pulsar antes el botón "Clear".
ENLACE2: escribe la fórmula (símbolos y números en orden correcto) en la casilla junto a "Type the formula here" (escribe la fórmula aquí). A continuación pulsa el botón "Calculate de molar mass" (calcula la masa molecular). La masa molecular aparece en la casilla junto a "Molar Mass =" y la composición centesimal en las casillas situadas inmediatamente a continuación de la anterior.
5.- CANTIDAD DE SUSTANCIA. EL MOL
En la vida real o en un laboratorio no se trabaja con átomos o moléculas aislados, sino con cantidades (gramos, kilogramos, ...) que contienen un número enorme de ellos. Para poder comparar cantidades de átomos o moléculas, los científicos emplean una magnitud específica: la cantidad de sustancia, n, cuya unidad es el mol.
Definición 1: Un mol es la cantidad de sustancia de un sistema que tiene tantas entidades elementales (átomos o moléculas) como átomos hay en 0,012 kg (12 g) de carbono-12.
Los 12 g de carbono-12, que se toman como referencia, contienen 6,022·1023 átomos. A este número se le llama constante de Avogadro, y es la cantidad de átomos o moléculas que contiene un mol de cualquier sustancia.
Definición 2: Un mol es la cantidad de sustancia que contiene 6,022·1023 entidades de dicha sustancia.
5.1- Masa molar
Al no ser posible contar los átomo o moléculas de una sustancia para saber qué cantidad de la misma tenemos, se utiliza el concepto de masa molar, que nos relaciona masa y cantidad de una sustancia:
La masa molar es la masa de un mol de entidades elementales (átomos, moléculas, iones, partículas, etc.) de una sustancia. Su símbolo es M y se expresa en kg/mol o en g/mol.
Cuando la masa molar se expresa en g/mol, su valor numérico coincide con la masa atómica o molecular relativa del elemento o compuesto.
La relación entre cantidad de sustancia, masa y masa molar es:
| cantidad de sustancia = | masa en gramos | ; n (mol) = | m(g) |
| masa molar | M (g/mol) |