|
UNIDAD DIDÁCTICA 6
|
|
|
|
LAS REACCIONES QUÍMICAS |
La materia puede sufrir cambios mediante diversos procesos. No obstante, todos esos cambios se pueden agrupar en dos tipos: cambios físicos y cambios químicos.
1.1- CAMBIOS FÍSICOS
En estos cambios no se producen modificaciones en la naturaleza de las sustancia o sustancias que intervienen. Ejemplos de este tipo de cambios son:
1.2- CAMBIOS QUÍMICOS
En este caso, los cambios si alteran la naturaleza de las sustancias: desaparecen unas y aparecen otras con propiedades muy distintas. No es posible volver atrás por un procedimiento físico (como calentamiento o enfriamiento, filtrado, evaporación, etc.)
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos.
En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen. Entonces, los átomos se reorganizan de otro modo, formando nuevos enlaces y dando lugar a una o más sustancias diferentes a las iniciales.
2.- CARACTERÍSTICAS DE LAS REACCIONES QUÍMICAS
Una reacción química se representa mediante una ecuación química. Para leer o escribir una ecuación química, se deben seguir las siguientes reglas:
Cuando una ecuación química cumple esta segunda regla, se dice que está ajustada o equilibrada. Para equilibrar reacciones químicas, se ponen delante de las fórmulas unos números llamados coeficientes, que indican el número relativo de átomos y moléculas que intervienen en la reacción.
Nota: estos coeficientes situados delante de las fórmulas, son los únicos números en la ecuación que se pueden cambiar, mientras que los números que aparecen dentro de las fórmulas son intocables, pues un cambio en ellos significa un cambio de sustancia que reacciona y, por tanto, se trataría de una reacción distinta.
Si se quiere o necesita indicar el estado en que se encuentran las sustancias que intervienen o si se encuentran en disolución, se puede hacer añadiendo los siguientes símbolos detrás de la fórmula química correspondiente:
Aquí tienes dos enlaces para ver cómo se ajustan las ecuaciones químicas:
4.- CÁLCULO DE LA MASA Y EL VOLUMEN A PARTIR DE ECUACIONES QUÍMICAS
Las ecuaciones químicas permiten calcular, a partir de una cantidad determinada de alguno de los reactivos y productos que intervienen en una reacción, la cantidad necesaria del resto de los componentes de la misma.
4.1- Cálculos masa - masa
En este caso nos aprovechamos de la relación que hay entre cantidad de sustancia (en mol), masa de sustancia y masa molar, tal como indica la relación:
| cantidad de sustancia = | masa en gramos | ; n (mol) = | m(g) |
| masa molar | M (g/mol) |
Para ver cómo se hace, lee el enunciado del problema siguiente y, a continuación pulsa sobre el gráfico:
|
Se quiere calcular la cantidad de cloruro de calcio que se obtiene cuando 50 g de carbonato de calcio se hacen reaccionar con la cantidad suficiente de ácido clorhídrico, en una reacción en la que se obtienen, además, agua y dióxido de carbono |
4.2- Cálculos volumen - volumen
La ley de Avogadro dice lo siguiente:
|
Volumenes iguales de diferentes gases en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas |
Esta ley implica que números iguales (por ejemplo, un mol) de partículas , átomos o moléculas, ocupan el mismo volumen, lo cual es muy útil para realizar cálculos de volúmenes en aquellas reacciones en las que intervengan gases.
Al igual que en el caso anterior, pulsa sobre el gráfico para ver cómo se plantea y soluciona un problema de este tipo:
Aquí tienes un par de actividades para practicar ambos tipos de cálculos:
5.- VELOCIDAD DE UNA REACCIÓN QUÍMICA
Para saber si una reacción es rápida o lenta, hay que conocer la velocidad a la que transcurre. Podemos definir velocidad de reacción como la variación de cantidad de sustancia formada o transformada por unidad de tiempo.
En general, para determinar la velocidad de una reacción, hay que medir la cantidad de reactivo que desaparece o la cantidad de producto que se forma por unidad de tiempo.
5.1- Factores que afectan a la velocidad de reacción
la velocidad de una reacción se ve influida por una serie de factores; entre ellos se pueden destacar:
Naturaleza de los reactivos
Se ha observado que según los reactivos que intervengan, las reacciones tienen distinta velocidad, pero no se ha podido establecer aún unas reglas generales.
Concentración de los reactivos
La velocidad de reacción aumenta con la concentración de los reactivos. Para aumentar la concentración de un reactivo:
Superficie de contacto de los reactivos
Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma.
Temperatura
En general, la velocidad de una reacción química aumenta conforme se eleva la temperatura.
Presencia de catalizadores
Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.
6.- IMPORTANCIA DE LAS REACCIONES QUÍMICAS
Estamos rodeados por reacciones químicas; tienen lugar en laboratorios, pero también en fábricas, automóviles, centrales térmicas, cocinas, atmósfera, interior de la Tierra... Incluso en nuestro cuerpo ocurren miles de reacciones químicas en cada instante, que determinan lo que hacemos y pensamos.
De toda la variedad de reacciones posibles, vamos a ver dos: las de neutralización y las de combustión. Pero antes de verlas, es necesario conocer y dominar el concepto de ácido y base.
6.1- Ácidos y bases
Las características de los ácidos y las bases se resumen en el siguiente cuadro:
| Ácidos | Bases | |
| ▪Tienen sabor agrio (ácido). | ▪Tienen sabor amargo. | |
| ▪Reaccionan con ciertos metales, como Zn, Mg o Fe, para dar hidrógeno | ▪Reaccionan con las grasas para dar jabones. | |
| ▪Reaccionan con las bases para dar sales | ▪Reaccionan con los ácidos para dar sales. | |
| Son sustancias ácidas: el ácido clorhídrico (HCl); el ácido bromhídrico (HBr); el ácido nítrico (HNO3); el ácido carbónico (H2CO3) y el ácido sulfúrico (H2SO4), entre otros | Son sustancias básicas el hidróxido de amonio o amoniaco disuelto en agua (NH4OH); y los hidróxidos de los metales alcalinos (LiOH, NaOH, KOH,...) y alcalinotérreos, como el Ca(OH)2, y Mg(OH)2, entre otros |
Para distinguir si una sustancia es ácida o básica, se utiliza la escala de pH, comprendida entre el 1 y el 14:
En los laboratorios y aquellos otros lugares donde es necesario determinan esta propiedad (como en un análisis de agua potable, por ejemplo), se utiliza un indicador ácido-base, que es una sustancia que presenta un color distinto según sea el pH del medio. Algunos ejemplos se muestran en las dos tablas siguientes:
| Indicadores | Color en medio ácido | Color en medio básico |
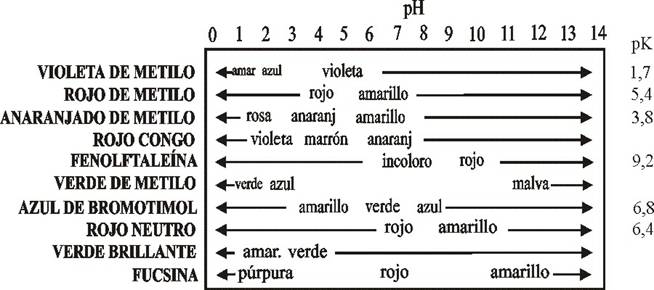 |
| Naranja de metilo | Naranja | Amarillo | |
| Fenolftaleina | Incoloro | Rosa | |
| Azul de bromotimol | Amarillo | Azul | |
| Tornasol | Rojo | Azul |
Para ahorrar tiempo y trabajo, se utiliza mucho el papel indicador universal, que es un papel impregnado con una mezcla de indicadores y que adquiere un color distinto según los distintos pH.
6.2- Neutralización
Cuando entran en reacción un ácido (por ejemplo, HCl) y una base (NaOH), el primero se disocia liberando H+ y Cl-, mientras que el segundo se disocia en Na+ y OH-. Los iones Cl- y Na+ se unen formando una nueva sustancia neutra (en este caso NaCl), llamada sal y los iones H+ y OH- se unen por su parte para forman H2O, es decir, agua.
|
acido + base → sal + agua |
6.3.- La combustión
La combustión es el proceso químico por el cual una sustancia, llamada combustible, reacciona con el oxígeno. En general, esta reacción es fuertemente exotérmica, desprendiéndose energía en forma de calor, luz o sonido.
Esta reacción no tiene lugar de forma espontánea, sino que, para que comience, ha de aportarse energía a través de una llama o de una chispa eléctrica. Eso si, una vez empezada, continúa por sí sola hasta que se agote el combustible o el oxígeno.
Es una reacción de gran importancia, tanto en la naturaleza como para la actividad humana, ya que es la forma en que los seres vivos y los artefactos humanos obtienen de forma muy mayoritaria su energía. Reacciones de combustión particularmente importantes son:
La combustión del carbono. Su ecuación química es la siguiente: C(s) + O2(g) → CO2(g). El producto es dióxido de carbono y se desprende energía lumínica y calorífica. Cuando esta reacción tiene lugar con poco oxígeno, la reacción es entonces: C(s) + ½O2(g) → CO(g), formándose monóxido de carbono, un gas venenoso y muy peligroso.
La combustión de hidrocarburos (compuestos cuya base es carbono e hidrógeno). En esta reacción se forma CO2 y vapor de agua. Es la reacción que tiene lugar en la combustión de los combustibles fósiles (carbón y petróleo), fuente básica de obtención de energía en nuestra sociedad. Un ejemplo de esta reacción es la combustión del metano:
| CH4(g) + 2O2(g) → CO2 (g) + 2 H2O (g) |
Un punto importante a destacar, es que los productos de la combustión, fundamentalmente el dióxido de carbono, tienen una gran incidencia cuando son liberados al medio ambiente, ya que este gas es el que produce mayor efecto invernadero.